P113: Atome sperren Elektronen ein
20. Quantensprünge in Atomen
Auch in der Elektronenhülle sind eingesperrte Elektronen. Sie können nicht weg, weil sie gebunden sind, also von den positiv geladenen Atomkernen angezogen werden.
Aber sie können auch nicht beliebig dicht an die Atomkerne kommen, weil sie dann so präzise Ortskoordinaten hätten, dass ihre Impulse unbestimmt wären, also auch ihre Energien E = p²/(2m).
Elektronen also in Kernnähe zu halten erfordern viel zu viel Energie. Das wirk wie (!) eine abstoßende Kraft (dummerweise nennt man sie Entartungskraft).
Aber das Wegsperren in der weit außen liegenden Elektronenhülle funktioniert...zum Glück...sonst hätten Chemiker/innen nichts zu tun und niemand wäre da, sich darüber zu wundern...
Wir werden uns bald mit dem Atom als Potenzialtopf näher auseinander setzen. Zuerst schauen wir einfach mal nach Indizien dafür. Diese waren schon lange vor der Erfindung der Quantenmechanik bekannt, konnten aber nicht richtig gedeutet werden.
Stellt euch das Atom einfach als einen Potenzialtopf für Elektronen vor.
20.1 Spektrallinien
Wir haben schon Spektren von atomaren Gasen gesehen. Sie bestehen aus einzelnen Linien bei bestimmten Wellenlängen. Leuchtet das Gas selbst, so sind es Emissionslinien, absorbiert das Gas Licht, so sind es dunkle Absorptionslinien im Farbband des Spektrums (Konitnuum).
Wir haben das in P35 kennengelernt:
 |
| Spektrentypen, Astro Uni Tübingen |
 | |
| Sonnenabsorptionsspektrum mit Linienprofilen, Baader |
 |
| Vergleich von Emissions- und Absorptionsspektren, Phyisik Uni Karlsruhe |
20.2 Anregung von Quantensprüngen
20.2.1 Anregung durch Photonen
Potenzialtöpfe können Photonen aussenden oder absorbieren. Wechselt das eingesperrte Elektron in einen tieferen (freien) Energiezustand, so gibt es den Differenzbetrag als Photon ab.
Umgekehrt benötigt es die Energie eines Photons, um in einen höheren Energiezustand zu wechseln. Dann ist das Photon absorbiert und bei dieser Stelle im Spektrum fehlen dann Photonen, d.h. das Spektrum wird dunkler. Das gibt dann die Absorptionslinien.
Für diese Wechselwirkung mit Photonen gilt:
Quantensprünge werden sicher angeregt, wenn die Energie des ankommenden Photons exakt gleich der Differenzenergie ist. Das kann man sich gut als eine Art Resonanz vorstellen.
Weicht die Energie des Photons etwas von der Differenzenergie ab, so sinkt die Wahrscheinlichkeit für eine Absorption. Das Verhalten ist näherungsweise durch eine Gaussche Verteilung zu beschreiben (Normalverteilung in der Stochastik).
In den Zusatzseiten habe ich dazu mehr geschrieben:
Also: Atome können durch Absorption von Photonen angeregt werden (d.h. ein Elektron geht in einen höheren Energiezustand). Das Photon wird vollständig absorbiert. Das ist ein Resonanzeffekt, d.h. die Energie des Photons muss möglichst genau der benötigten Energie entsprechen.
Bei weniger oder mehr Energie sinkt die Absorptionswahrscheinlichkeit schnell zu 0.
Deswegen sind Absorptionslinien so schmal!
Hier das Profil einer Emissionslinie:
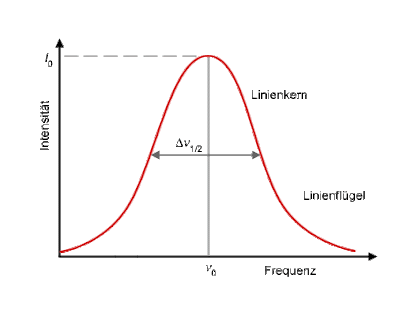 |
| Chemgapedia |
Es gibt aber noch eine zweite Möglichkeit:
20.2.2 Stoßanregung
Elektronen können Atome anstoßen und beim Stoß ihnen Energie zuführen, durch die ein inneres Atomelektron dann einen Quantensprung macht.
Hier muss das Elektron mindestens die notwendige Energie zur Anregung haben. Ist die kinetische Energie des stoßenden Elektrons zu klein, so wird der Stoß elastisch, d.h. das Elektron prallt am Atom ab und gibt ihm keine Energie.
Hat das stoßende Elektron zu viel Energie, so behält es einfach den Rest.
Ganz wichtig:
Anregung durch Photonen: Die Energie muss passen
Anregung durch Elektronenstoß: Nur die Mindestenergie muss zur Verfügung stehen.
20.3 Stoßanregung in Gasen
Eine solche Anregung können wir in einer Gasentladungsröhre untersuchen.
In Q1 haben wir gelernt:
In verdünnten Gasen können sich Elektronen durch eine zwischen Kathode und Anode angelegten Spannung bewegen.
Sie stoßen dabei an Atome an und regen diese zum Lichtaussenden an. Wir haben damals das charakteristische Leuchten verschiedener Gase untersucht (das gelbe Natriumlicht, das rötliche Neonlicht, das bläuliche Licht von Quecksilberdampf).
Schon damals haben wir manchmal ringförmige Leuchtstrukturen gesehen. Nun verstehen wir sie.
Hier das Experiment dazu:
Versucht es einmal selbst mit der Erklärung:
Die Elektronen werden durch Heizung der Kathode freigesetzt (Glühemission).
Sie starten dort mit der kinetischen Energie 0 und werden durch das elektrische Feld zwischen Kathode und Anode beschleunigt (angelegte Spannung). Ihre Energie wächst.
Ständig stoßen sie an Atome an.
Warum entsteht "plötzlich" Licht?
Warum wird es anschließend wieder dunkel?
Warum kommt dann ein weiterer heller Streifen?
Was passiert mit den Streifen, wenn ich die Spannung zwischen Kathode und Anode erhöhe?
Denkt bitte daran, dass die Elektronen nur Energie abgeben, nicht aber vom Atom verschluckt werden.
James Franck (1882-1964) und Gustav Hertz (1887 -1975, nicht der mit der Einheit Hz...das war sein Onkel Heinrich Hertz (Entdecker der Radiowellen)) haben das alles sehr genau 1914 utnersucht und vermessen undu.a. dafür später den Nobelpreis bekommen.
Darauf gehen wir bald kurz ein (ist 2021 kein Abithema, ich werde das für spätere Generationen auf den Zusatzseiten ergänzen), aber erst einmal müsst ihr die Streifen erklären und ich die Lösung aufschreiben...




Kommentare
Kommentar veröffentlichen