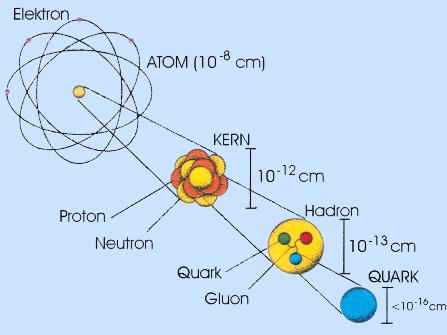
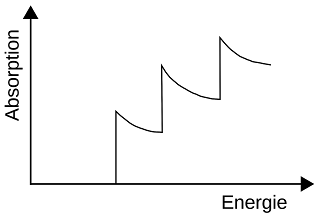
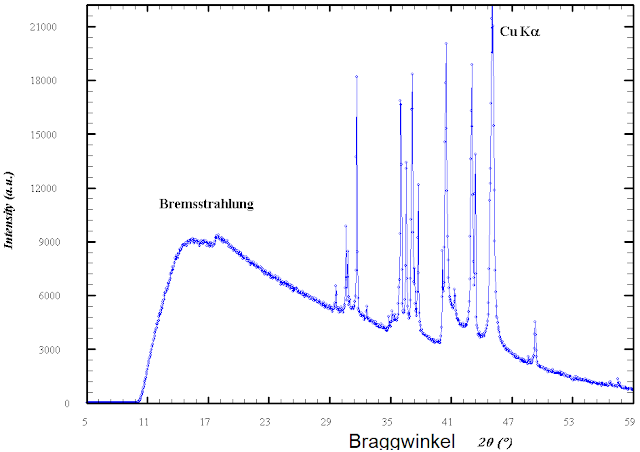
Ratschlag für Neulinge
Blogspot ist nicht sehr komfortabel, wenn man von Vorne systematisch durcharbeiten will...Ich könnte die Reihenfolge der Posts umstellen...aber dann hat man bald das gleiche Problem. Angeregt durch einen neuen Nutzer gebe ich den folgenden Ratschlag (so mach ich es): Unter Posts (linke Seite) kann man sich alle Posts eines Monats aufrufen lassen. (Links, unter demInhaltsverzeichnis) Da geht man nach unten, klickt den Post mit der kleinsten Nummer an...liest... Dann nicht innerhalb des Blogs zurückgehen , sondern innerhalb des Browsers...dann ist man wieder auf der Monatsseite und kann den nächsten Post aufrufen. Das Inhaltsverzeichnis habe ich nur als Textseite einfügen können, nicht interaktiv. Für den Kurs damals war es ok, dass jetzt der Blog so weit genutzt wird, war nicht abzusehen...freut mich aber sehr. Trotzdem hilft das Inhaltsverzeichnis, denn man behält den Überblick, wo im Kurs man ist. Bitte auch die Zusatzseiten beachten! Übergeordnete Postzusammen...