P 109: Quantensprünge
19.4 Quantensprünge und Lichtentstehung
Wir wollen mit usnerem Modell des "linearen Potenzialtopfes mit unendlich hohen Wänden" noch etwas Physik diskutieren.
Zuerst setzen wir ein Elektron in den Topf. Praktisch gesehen dürfte das bei unendlich hohen Wänden schwierig sein, aber es ist ja ein Gedankenexperiment mit einem Topf, den es so eh nicht geben kann.
Was wird das Elektron machen?
Wie jedes System wird es den Zustand geringster Energie annehmen, d.h. es wird von den oberen Energiezuständen in einem oder mehreren Zwischenschritten in den Grundzustand E1 gehen.
Dabei muss es Energie abgeben. Das kann es nur in Form von Photonen.
Für jeden Energieübergang gibt es nur eine mögliche Photonenenergie:
h*f = Em - En (Em ist die Energie des höheren und En des tieferen Niveaus).
Zu jeder möglichen Photonenenergie gehört genau eine Wellenlänge.
Damit haben wir ein Modell für die Entstehung von Emissionsspektren von atomaren Gasen gefunden!
Diese Art der Emission nennt man spontane Emission, da sie innerhalb einer hundertmillionstel Sekunde stattfindet.
So richtig spontan ist sie nicht, wir werden später sehen, dass sie durch Vakuumfluktuationen angeregt wird.
Beim Lasermechanismus werden wir lernen, dass es auch Energieniveaus gibt, in denen die Elektronen bis zu mehreren Minuten sein können, bevor sie in tiefere Zustände übergehen. Diese Niveaus werden wir metastabil nennen, den Übergang induzierte Emission.
Fragen dazu:
Auf welchem Weg kommen die Elektronen z.B. von m=3 auf n = 2?
Wie lange dauert das?
Die Lösungen stehen am Ende des Posts.
Es ist üblich, den Übergang eines Elektrons von einem höheren Energieniveau in ein tieferes als Quantensprung zu bezeichnen.
Höhere Energieniveaus bezeichnet man auch häufig als angeregte Energieniveaus.
 |
| Quantensprünge im Atom |
Berechnung von Spektren:
Nun rechnet einmal das Spektrum unseres Potenzialtopfes aus.
In Aufgabe 4 von P 107 habt ihr die Energieniveaus berechnet.
Wir wollen jetzt die folgenden Übergänge betrachten:
Von m = 5, 4, 3, 2, auf jeweils n = 1 (vier Übergänge)
Von m = 5, 4, 3 auf jeweils n = 2 (drei Übergänge)
Zu jedem Übergang gehört eine Energie(differenz). Diese könnt ihr umrechnen in Frequenzen ( über h*f) und dann in Wellenlängen (über c).
Am besten schreibt ihr die Gesamtformel auf. Die müsst ihr immer wieder herleiten und erklären können:
ΔE = Em-En = h*f = h*c/λ
Aufgabe 1:
Berechne die Wellenlängen der oben angegebenen Übergänge.
Aufgabe 2:
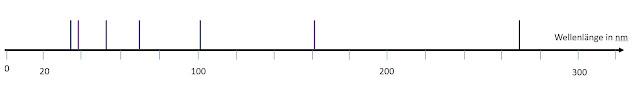
Zeichne das Emissionsspektrum:
Nun zeichnet das Emissionsspektrum unseres Potenzialtopfes. Ihr tragt einfach die (ungefähre) Lage der Emissionslinien auf einer Wellenlängenskala auf.
Aufgabe 3:
Im welchem Bereich der EMW würde unser Potenzialtopf strahlen, wenn man ein Elektron hineingibt?
Lösungen:
- Es gibt keine Wege in der QM. Das ist ein Quantensprung.
- Nach der Unbestimmtheitsbeziehung für Energie und Zeit kann man für diese Übergänge nicht genauere Zeitbereiche als etwa eine Billiardstel Sekunde angeben (nachrechnen!).
Sie sind aber langsamer und lassen sich inzwischen sogar zeitaufgelöst beobachten.
Meine Wellenlängen (ich verrechne mich oft...):
Übergänge auf n=1:
269 nm, 101 nm, 54, nm, 34 nm
Übergänge auf n= 2:
161 nm, 68 nm, 39 nm
Spektrum:
>>> kurzwelliges UV bis Röntgenstrahlung
Zum Vergleich: Bei λ = 234 nm arbeiten die UV-Desinfektionsgeräte für Corona-Viren.
Hier ein "echtes" Emissionsspektrum im sichtbaren Bereich:

Kommentare
Kommentar veröffentlichen