P 170 Zum Schluss geben wir uns die Kante (K)
43. Absorptionskanten
43.1 Entstehung der Kanten
Röntgenstrahlen können auch von inneren Elektronen absorbiert werden. Dann entstehen Absorptionskanten, die man mit den Absorptionslinien vergleichen kann.
 |
| wikipedia |
Das eigentliche Problem sind die unterschiedlichen Weisen der Darstellung.
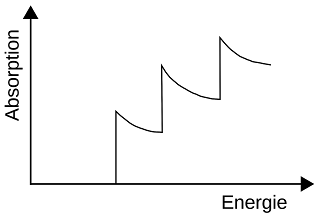
Im oberen Bild ist auf der x-Achse die Energie der Röntgenphotonen aufgetragen (nach rechts wird die Wellenlänge kürzer). Bei einer bestimmten Energie kann das Material die Röntgenstrahlung aufnehmen, die Absorption steigt an, man sagt auch der Absorptionskoeffizient nimmt zu. Das geschieht schlagartig, deshalb entsteht eine Kante.
Wenn die Energie der Röntgenphotonen dann weiter steigt, dann sinkt die Absorptionswahrscheinlichkeit (wie bei einer Absorptionslinie im Optischen), bis eine neue Absorptionsmöglichkeit mit neuer Kante auftritt.
Was passiert da?
Das erklärt das nächste Bild:
 |
| Uni Düsseldorf, Röntgenlab |
Links sehen wir die Entstehung der Emissionslinien:
1. Ein Elektron aus der L-Schale wechselt auf einen freien Platz der K-Schale und
2. es entsteht ein Röntgenphoton mit der Bezeichnung Kα.
Rechts sehen wir die Entstehung der K-Absorptionskante:
1. Ein Röntgenphoton der richtigen Energie trifft auf ein Elektron der K-Schale.
2. Dieses Elektron absorbiert das Photon und verlässt hier das Atom.
Eine Kante entsteht, weil das ankommende Photon wirkungslos ist, wenn es nicht mindestens die notwendige Energie hat.
Der Abfall nach der Kante entsteht, weil einfach die Absorptionswahrscheinlichkeit sinkt, wenn die Energie zu groß ist.
Entsprechend ist es auch mit der L-Kante!
43.2 Vergleich Emission, Absorption
Nun etwas Gehirntraining (es hilft euch alles besser zu verstehen, aber ich glaube nicht, das so etwas im Abitur eine Rolle spielt, obwohl...das Bild ist aus Leifi...also auch denjenigen bekannt, die Abiaufgaben machen...):
 |
| leifiphysik |
Achtung aufgepasst: Energie nimmt nach links zu, die Wellenlänge nach rechts...
Mit dieser Info müsstet ihr den unteren Teil verstehen.
Wir haben ja gelernt, dass die L-Schale aus drei Unterniveaus besteht: 2s1/2, 2p1/2, 2p3/2 (Feinstruktur, siehe: Post 136).
 |
| Feinstruktur beim Wasserstoffspektrum |
Der Übergamng 2s1/2 zu 1s1/2 ist verboten.
Also gibt es bei der L-Schale zwei Absorptionskanten.
Und nun schauen wir uns den oberen Teil an (Emissionsspektrum). Es gibt zwei Kα - Linien, da das Rücksprungelektron aus der L-Schale sowohl aus 2p1/2 und 2p3/2 kommen kann (2s1/2 war ja ein metastabiles Niveau, der Übergang war verboten...bevor das Elektron springt, hat ein anderes schon die Lücke gefüllt).
Energiereicher ist die Kβ - Linie, denn hier füllt ein Elektron aus der K-Schale die Lücke. Auch hier gäbe es mehrere Linien, das vereinfacht man hier....
So, und nun die Masterfrage:
Warum liegt die K-Kante links vom Emissionsspektreum, also links von Kβ??
Schaut euch nochmal das Bild an:
Die Energiedifferenz für die Emission von Kβ (Blauer Pfeil links) ist kleiner als die für die Absorption (blauer Pfeil rechts). Somit muss die K-Kante bei höherer Energie, also kürzerer Wellenlänge auftauchen.
43.3 Absorptionsgesetz
Bei der Behandlung der Differenzialgleichungne in Q2 haben wir auch die Absorption kennen gelernt:
Sehr häufig gilt eine exponentielle Absorption. Die Änderung dI der Intensität ist proportional zur Intensität I(x) an der Stelle x und der Wegänderung dx.
Man erhält:
dI = - a* I(x) * dx
Das Minuszeichen steht, weil beim Absorbieren die Intensität abnimmt, a ist der sog Absorptionskoeffizient:
a = - dI/I*dx = prozentuale Abnahme der Intensität pro Strecke.
Zur Erinnerung: dI ist der Prozentwert, I der Grundwert, dI/I der Prozentsatz
Wenn man diese Differenzialgleichung durch Trennung der Variablen löst, erhält man dI/I = -a*dx und durch Integrieren dann das exponentielle Absorptionsgesetz:
I(x) = Io * exp(-a*x).
43.4 Ausblick
Zwei Dinge will ich erwähnen, die früher in Abiaufgaben eine große Rolle gespielt haben:
43.3.1 Moseleysches Gesetz
√E = √k * (Z-2)
Dies ist ein Zusammenhang zwischen der Energie der Absorptionskante und der Kernladungszahl Z des absorbierenden Materials.
Eigentlich steht da E = k * (Z-2)² (E in eV, dann auch k in eV)
Mit der Wurzelformel kann man linearisieren und dann die Ionisationsenergie k = 13,6 eV von Wasserstoff bestimmen.
43.3.2 Comptoneffekt
Das ist ein vollkommen falsch in allen Büchern dargestellter Effekt, der auch in den ersten Jahren der Quantenmechanik fehlinterpretiert wurde und deshalb der Photonenvorstellung zum Durchbruch verholfen hat.
Der Zusammenstoß eines Röntgenphotons mit einem Elektron gehorcht den Energie- und Impulserhaltungsgesetzen und "beweist" die Teilcheneigenschaften der Röntgenstrahlung.
Es fliegt ein energieärmeres Photon weg.
 |
| leifiphysik |
Ein Elektron absorbiert ein Photon. Das Elektron sendet ein neues Photon geringerer Energie aus und bewegt sich.
Es sind also keine 3 sondern 4 Quanten beteiligt.
Man kann den Comptoneffekt komplett mit Wellenbildern erklären. Aus ihm kann man nicht, wie fälschlicherweise geschieht, auf Teilcheneigenschaften von irgendetwas schließen.
Ich schreibe für Interessenten dazu eine Zusatzseite, auch für spätere Jahrgänge...denn der Comptoneffekt kommt bestimmt bald wieder im Abi dran....
######################################################################
So, dass war der reguläre Stoff.
Es kommen noch zwei Abschlussposts.., etwas über Kosmologie "Die Geschichte Deines Universums vom Urknall bis zu Dir") und eine filmische Überraschung.
Aber hier endet unser regulärer Unterricht.
Ein Schuljahr, gerade jetzt im Moment wieder, geprägt durch Unwägsamkeiten durch ein Virus, das diesen Planeten in die Knie gezwungen hat und die Unfähigkeiten vieler Menschen offengelegt hat.
Es war mir eine Ehre, Euch in dieser Zeit unterstützen zu dürfen.
Bleibt gesund.

Kommentare
Kommentar veröffentlichen