P 133: Zahlenmagie
22.4 Die Quantenzahlen
In diesem Kapitel entwickeln wir gleichzeitig das System der Quantenzahlen und veranschaulichen es mit dem Orbitalmodell der Quantenmechnik, das sich durch Lösen der Schrödigner Gleichung ergibt.
Das hier dargestellte Modell wird auch als Bohr-Sommerfeldsches Atommodell bezeichnet.
22.4.1 Hauptquantenzahl n
Das ist das n, welches wir schon in unseren Rechnungen kennengelernt haben. Diese Quantenzahl legt grob die Energie fest.
Statt n= 1,2,3,4...schreibt man auch K, L, M, N...
In der Chemie spricht man von Schalen: n=1 ist die K-Schale.
22.4.2 Nebenquantenzahl l
Wir interpretieren rein klassisch:
Eine Bahn kann unterschiedliche Formen haben, sie kann kreisförmig sein oder unterschiedlich stark abgeplattete Ellipsenform haben.
Die möglichen Bahnformen unterscheiden sich auch energetisch.(Auf einer Ellipsenbahn kommt ein Elektron auch mal näher an den Kern, in der Regel sind das dann etwas höhere Energien).
Sie sind auch gequantelt, die Zahlen sind l = 0, 1, 2,3,..., n-1
Dafür kann man auch s,p,d,f,... schreiben. Das sind die Unterschalen.
Diese Buchstaben kommen von der Art der Spektrallinien her: s steht für sharp, d für diffus...usw...
Quantenmechanisch ist das eine Unterscheidung der Bahndrehimpulse.
l beschreibt also den Bahndrehimpuls L = m*v*r des Elektrons.
Bei s (l=0) ist der Bahndrehimpuls 0. Die Wahrscheinlichkeitsverteilung ist kugelförmig. Wer sich eine Bahn vorstellen möchte, sollte es mit eienr Kreisbahn probieren.
Bei p (l=1) ist die Wahrscheinlichkeitsverteilung keulenförmig. Das ergibt die gerichteten Verbindungsmöglichkeiten in der Chemie. Und dazu würden Ellipsenbahnen gehören.
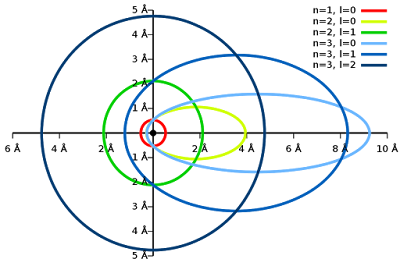 |
| Wikipediacommon (1 Angström = 0,1 nm) |
22.4.3 Magnetische Quantenzahl m:
In einem äußeren Magnetfeld (da reicht auch das des Atomkerns aus) können die Elektronenbahnen utnerschiedliche Neigungen haben. Auch diese Neigungen sind gequantelt. Man braucht die Zahlen m = -l, -l+1, -l+2,...-1, 0, +1, 2, ...l-1, l.
Eine Bahn mit dem Drehimpuls l hat also (2l+1) - mögliche Einstellwinkel in Magnetfeldern.
Jede Einstellung besitzt eine geringfügig andere Energie. Verläuft die Bahnebene parallel zum Magnetfeld, so ist die Energieänderung gleich 0. Steht die Bahn senkrecht zum Magnetfeld, so ist je nach Magnetfeldrichtung die Energie am kleinsten oder am größten.
Das ist etwas salopp ausgedrückt, denn l ist ja kein Bahndrehimpuls, sondern nur eine ihm zugeordnete Quantenzahl, ebenso ist m kein Winkel.
Diese Energieunterschiede führen zur Aufspaltung aller Spektrallinien in Magnetfeldern (Zeeman-Effekt). Damit messen Astronomen Magnetfelder im Kosmos aus.
22.4.4 Wie sehen Orbitale aus?
Die Quantenmechanik (man muss die Schrödingergleichung lösen) liefert die Wahrscheinlichkeiten für die zu einzelnen Quantenzahlen gehörenden Zustände.
Die kann man dann skizieren und erhält eine bildliche Vorstellung der Orbitale, also der Wahrscheinlichkeitsverteilung der Elektronen (entnommen aus: chemistry for non-majors):
 |
| s-Orbitale |
 |
| p-Orbitale |
 |
| d-Orbitale |
 |
| f Orbitale |
Das erinnert ein bisschen an Chladnische Klangfiguren (hatten wir in der E2, Metallplatten mit Sand bestreut...).
 |
| TF Uni Kiel |
Ja, die Elektronenhülle ist eine räumliche stehende Welle mit Grund- und Oberschwingungen.
Wenn ihr in einer engen Duschkabine singt (und durch die Resonanzen meint, ihr würdet gut klingen), dann wisst ihr wie es einem Elektron in einer Elektronenhülle geht...
Was ist ein Tisch?
Eine Ansammlung vieler Duschkabinen, bei denen sich die Sänger auf eine gemeinsame Melodie einigen.
Übrigens, so funktioniert auch unser Gehirn: Wenn Neuronen eine gemeinsame "Melodie" spielen, dann kommt uns ein Gedanke.
Die Symphonie in unserem Kopf entdeckt die Symphonie der Quanten in der Natur.
Das nennen wir Wirklichkeitskonstruktion.
22.4.5 Spinquantenzahl s
Jetzt haben wir die Schale n zerlegt in die durch l charakterisierte Unterschalen. In jeder dieser Unterschalen gibt es durch m charakterisierte Bahnneigungen.
Nach dem Pauliprinzip passen nun auf jede Bahn genau zwei Elektronen, vorausgesetzt sie rotieren unterschiedlich, denn dann haben sie leicht utnerschiedliche Energien. (Ein sich drehendesn Elektron ist ja ein Elementarmagnet, und dieser richtet sich unterschiedlich zum Magnetfeld der Elektronenbahn aus).
Die Spinquantenzahl hat also die Werte s = +/- 1/2.
Achtung: Der Buchstabe s taucht hier mit zwei vollkommen unterschiedlichen Bedeutungen auf:
Bei der Nebenquantenzahl bedeutet s, dass l=0 ist und die Wahrscheinlichkeitsverteilung kugelförmig ist, also kein Drehimpuls vorliegt.
Beim Spin ist s die Spinquantenzahl und kann die beiden Wert +/- 1/2 annehmen.
Der Unterschied muss aus dem Zusammenhang erschlossen werden...
22.4.6 Anzahl der Zustände
Wir können jetzt auch das Pauliprinzip für Atome formulieren:
In einem Atom dürfen keine zwei Elektronen in allen Quantenzahlen übereinstimmen.
Die Quantenzahelen (n,l,m,s) legen genau ein Elektron fest.
Die folgende Tabelle schreibt die Zahl der Zustände auf und die Gesamtzahl der möglichen Zustände in einer Schale:
K:
n=1
l=0 (s)
m = 0
s=+/- 1/2
Zwei Zustände
Beschreibung:
In die K-Schale passen also maximal zwei Elektronen.Das wird die Elemente H und He liefern.
L:
n=2
l = 0, 1, d.h. s und p
Für s ist m=0
Für p ist m= -1, 0, +1
s= +/- 1/2
Die Zustände in der L-Schale sind also:
In die L-Schale passen also 8 Elektronen.Das ist die erste Periode im Periodensystem, ihr alle kennt die "abgeschlossene Außenschale"...
Sind alle Zustände in der K-Schale besetzt, ist der Gesamtdrehimpuls 0.
Überlagert mal alle s- und p-Orbitale...das ist voll kugelsymmetrisch!
Der Motor der chemischen Reaktionen ist das Streben nach Symmetrie.
M:
n=3
l= 0,1,2, also s,p, d
s: m=0
p: m=-1,0,1
d: m =-2, -1, 0, +1, +2
Dazu jedesmal s=+/-1/2
Die M-Schale hat also die folgende Elektronenkonfiguration (so nennt man das Schema):
Rechnet mal nach, wo die Zahl 10 der 3 d- Elektronen herkommt...
3s und 3p bilden wieder eine 8-ter Außenschale, die 3d Elektronen erzeugen die Nebengruppenelemente der ersten Nebengruppe.
In die M - Schale passen also 18 Elektronen.
Anzahl der Elektronen in der Schale mit der Nummer n: 2*n²
Also:
K (n=1) 2 Elektronen
L (n=2) 8 Elektronen
M (n=3) 18 Elektronen
N (n=4) 32 Elektronen
O (n=5) 50 Elektronen
Damit haben wir 110 mögliche Fälle...das Periodensystem hat 92 Elemente, dafür reichts..
Transurane:
Elemente mit mehr als 92 Protonen/Elektronen werden heute bis Z=121 künstlich hergestellt. Sie haben teilweise eine extrem kurze Lebensdauer. Für die braucht man dann noch die P-Schalen.
22.4.7 Ausblick auf das Periodensystem
Hier noch einmal das Periodensystem. Versucht einmal die oben genannte Zahlenmystik in der Anordnung der Elemente wiederzufinden.
Im nächsten Post bauen wir es auf...
22.4.8 Elektronenkonfiguration von Sauerstoff und Kohlenstoff
Sauerstoff hat 8 Protonen (Z=8), also müssen wir 8 Elektronen unterbringen:
Chemiker/innen wissen: Sauerstoff hat 6 Außenelektronen.
Hier eine Darstellung, an der man auch grob die Energien vergleichen kann:
Kohlenstoff hat 6 Elektronen, also hier die Konfiguration:
Die vier Außenelektronen sitzen in s- und p-Unterschalen. Die sind energetisch nicht gleichwertig.
Bei der sog. Hybridisierung überlagern sich diese vier unterschiedlichen Orbitale zu gleichwertigen Hybridorbitalen . C wird 4-wertig.
Diesem quantenmechanischen Vorgang der Überlagerung von Zuständen haben wir die Komplexität unseres Lebens zu verdanken.
Silizium kann das nicht...nur Kohlenstoff...
Also vereinfacht ausgedrückt: Dass ihr zum Mittagessen Gemüse oder Fleisch verzehrt und euch nicht an `ne Steckdose hängt, hat was mit der Quantenmechanik und der Hybridisierung zu tun...
22.4.9 Gesamtdrehimpuls
Will man die Energien präziser berechnen, dann muss man aus dem Spin S des Elektrons und seinem Bahndrehimpuls L den Gesamtdrehimpuls J machen.
Da gibt es bei unterschiedlichen Atomen zwei Wege:
1) Alle Bahndrehimpulse bilden eine Summe, alle Spins bilden eine Summe, die beiden Summen addieren sich (Russell-Saunders-Koplung)
2) Häufiger ist: Für jedes Elektron gibt es eine Summe aus L und S zu seinem persönlichen J. (LS-Kopplung)
Natürlich ist das J, der Gesamtdrehimpuls, auch gequantelt. Die Quantenzahl heißt j, sie kann immer zwei Werte annehmen: j = l +/- 1/2.
Diese Werte schreibt man unten an die Buchstaben:
Also die p-Zustände (l=1) gibt es in zwei Energiefomrmn
j = 1 + 1/2 = 3/2 oder j = 1 -1/2 =1/2.
Für s ist ja l=0, da geht nur j = 0+1/2 =1/2
Die Bahn liefert bei s keinen Drehimpuls, nur der Spin. Die beiden möglichen Richtungen drückt man durch j nicht aus, aber es können nach dem Pauliprinzip zwei Elektronen in das Niveau.
Das sieht dann bei Kohlenstoff so aus:
Nu schickets...
Päus`chen und dann bauen wir das Periodensystem auf...
Ihr könnt das ja für die ersten 85 Elemente mal selbst machen....
Abgabe: nächste Woche...








Kommentare
Kommentar veröffentlichen